医療現場においてデジタル化の急速な浸透により循環器分野における画像診断を取り巻く環境も近年大きく変わりつつある。2次元のX線画像から3次元CTへと、また白黒の静止画像で行われていた診断からカラーの動画を用いた複雑な機能診断へと急速な変貌を遂げており、画像診断から多岐にわたる情報を得て臨床に用いるようになった。こうした技術革新の中、超音波や放射線画像から何らかの手段で心臓や血管内の血流を可視化し流体工学の視点から血流を観察し診断につなげようという動向が活発になってきている。血流の可視化技術は血流をベクトルや流線などで直感的に捉えることを可能にするだけでなく、血流動態の良し悪しを数値として表す様々な指標を計算することも可能であり、循環器診療に新たな視点をもたらすものとして期待されている。
Vector Flow Mapping (VFM) はそうした流れの中で開発された超音波診断から血流をベクトルとして可視化する手法である1。VFMは、同様に血流を可視化する手法であるPhase Contrast MRIに比べて圧倒的に簡便に扱うことが可能で、臨床現場に根ざした診療モダリティになる可能性を大いに秘めている。本項ではVFMの基本的な原理や考え方について、MRIやコンピュータ血流シミュレーションとの対比も交えながら解説を行う。
超音波Vector Flow Mapping(VFM)とは
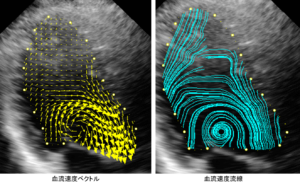
超音波VFMは超音波カラードプラ画像と壁運動のスペックルトラッキングを組み合わせ、ある種の演算を介して血流速度をベクトルとして可視化する手法で、Figに示すように縦横2つの速度成分を持ったベクトルとして血流速度を表示できる。従来のカラードプラはプローベから出るビーム方向の1次元的な血流速度しか計測できなかったが、VFMでは方向に縛られること無く2次元のベクトルとして速度がわかる。Figのように、房室中隔欠損で房室弁に逆流が発生しているような症例においてもVFMではビーム方向に垂直な方向の速度も算出されるため、房室弁逆流や心内血流の流量を計測するだけでなく、心室中隔欠損孔を通過する血流量も計測することが可能である。一方、Fig. 3に示すのは成人正常左室内の血流をVFMで解析したものである2。拡張流入期の初期の時相において流入血流に付随して僧帽弁前尖と後尖の周囲にvortex ringとして知られる渦流が生じている3。緩徐流入期には後尖側の渦流は消失するが、前尖側の渦流は心尖部方向に向かって伝搬しながら拡大していく。駆出期に弁が解放されるとこの渦流の向きに沿うようにして血流が駆出される。このように渦流が流入した血流を滑らかにターンさせて流出路方向へ導いているように見える。
VFMのメカニズム
カラードプラ法は周知のようにプローベから出るビーム上の速度をプローベに向かう方向への血流を赤で、遠ざかる方向の速度を青で表示する計測方法である。これにより計測面内の各点でビーム方向に限った血流速度がわかる。これに加えてビームに直交する方向の速度もわかれば血流場をベクトルとして表すことが可能である。
VFMはこのビーム直交方向の血流速度を流量の保存則に基づいて演算している。流量の保存則というは満タンの容器に水を入れたら、入れた量と同じだけあふれるというごく当たり前の法則である。超音波の計測面で異なる面から流入や流出が一切無いと仮定したならば、断面内に仮想的な四角形を描いた場合、その四角形に入ってくる流量と出ていく流量は等しい。このとき四角形の上下の2辺では流入・流出する量がカラードプラから判明しているので、さらにもう1辺、左右のどちらかの辺で流量がわかっていれば、残った最後の一つの辺の流量もわかるはずである。ここでこの四角形の左右の1辺が心筋壁に接する部分に置くと、心筋壁が血液を押す量が1辺の流量であると考えても良いので、残った一辺の流量が判明する。続いて、その横に同じように四角形を描いても上下の辺の流量はカラードプラから、またもう1辺が前に判明したとなりの四角形からの流量でわかるので反対側の最後の一辺の流量が判明する。これを順々に繰り返していけば断面内全体での横向きの流量がわかるのである。
ソフトウェア上ではFigのようなマス目を計測断面上におき、それぞれのマスで流量の保存則を解くことで横向きの血流速を演算している。演算の最初に用いる壁の速度はBモード白黒画像からスペックルトラッキングで壁の動きを追跡し、フレームごとの移動距離から壁運動速度を計算している。
このコンセプトは2010年にGarciaらが発表した方法で 4、非侵襲で血流可視化が可能で理論も明解であるため注目を集めた。VFMはこの手法を改良したもので、スペックルトラッキングのアルゴリズムを改良し心筋壁運動の速度をより正確に捉えることができる工夫や、カラードプラの信号ノイズ除去の最適化などにより極めて再現性の良い渦流を可視化することが可能となり、ファントム実験にもとづきその正確度や精度が検証されている5。
同様に超音波計測を用いて血流を可視化する技術として前述のGarciaらの手法の他にechodynamography(旧VFM)6とecho PIV7が存在する。 Echo PIVは粒子状の造影剤を注入し、Bモード画像から粒子配置のパターンをフレームごとに追跡することで計測平面上の血流の向きと大きさを計算する手法である。心内の渦流などを可視化する上で強力なツールであるが、精度良く安定して可視化するために継続的に造影剤を注入する必要があり8、侵襲性が高く日常的にecho PIVを用いる上で大きな制限になるであろう。EchodynamographyはVFMという名前でアロカ株式会社から販売されたが、現VFMとは全く異なるものである。カラードップラーデータの赤と青のパターンから渦流成分と基本流成分に分割を行い、それぞれの流れを数学的な関数から推定し再び合成するという手法で可視化を行っており、超音波計測で非侵襲的に血流を可視化する手法として先進的かつ斬新な方法であった。しかし、流体力学的な理論が脆弱で渦流の検出が一意に決まらず検出の仕方で異なる流れの様相が可視化されるなどといった問題が存在した。
本稿では「VFM」をCardio Flow Design社や日立アロカメディカル株式会社から発売されたソフトウェアの商品名として用いているが、近年VFMや旧VFM、Garciaらの手法などカラーデータを用いて血流を可視化する技術の一般名称として”cardiac Doppler vector flow mapping (VFM)”が用いられる場合もある9。
超音波計測を用いる方法の他に、代表的な血流可視化法として、位相コントラストMRI (Phase Contrast Magnetic Resonance Imaging: PC MRI)がある。PC MRIは傾斜磁場中を通過する血液からの信号の位相の変化が傾斜磁場方向の血流速度に比例することを利用して、血流の速度を撮影し可視化する手法である10。撮影された3種類の画像(X方向、Y方向、Z方向速度画像)の各ピクセルのコントラストが直接血流速度を意味するため、VFMのように演算による血流速の推定がいらない。最大のメリットとして3次元の血流速度場を撮影でき、3次元で撮影されたPC MRIは特に3D Cine PC MRIとか4D Flow MRIといった名称で呼ばれる。しかし、撮影に10分~40分程度と長時間かかるため撮影に適する症例が限られ、また可視化のための環境も十分に整備されているとは言い難い。例えば、撮影や可視化処理の一般的なプロトコルが存在しないため、撮影する技師やMRIの装置、解析用のソフトウェアの違いなどによって同じ血流を撮影しても算出される指標が全然違ってしまうということも起こりうると考えられ、こうした問題に対してより多くの精度検証が必要である。また空間・時間分解能が低く小さな血管では誤差が大きく解析に向かないという制約もある。現状ではMRIの血流可視化技術は研究ベースの利用に留まっており、臨床現場で使えるようになるにはまだまだ時間がかかるであろう。
VFMとPC MRIは同様に血流の速度ベクトル分布が得られるが、将来的には可視化に掛かる手間や時間、得られる情報量などを天秤にかけ両モダリティを症例に応じて使い分けていくことになると我々は考えている。
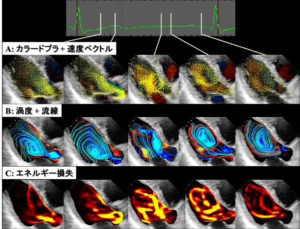
また、VFMではエネルギー損失や壁ずり応力、渦度といった流体力学的に定式化されている指標を計測することも可能である。血流場のベクトルからは渦流の大きさや向き、弁狭窄部のジェット流など大局的な流れの特徴を直感的にわかりやすく表示することができるが、こうした流れが生体内で合目的性を持って存在しているのか、あるいは心臓にとって不利に働いているのか判別が難しい。そこで様々な指標を算出することでこのような血流が臨床的にどのような意義を持っているのかということを論じることが可能である。例えば、エネルギー損失は余剰な心負荷を意味するもので小児先天性心疾患の血流可視化においてもエネルギー損失はよく用いられ、Norwood手術を始めとした再建大動脈の血流や、Fontan循環などのエネルギー効率を見ることで遠隔期の心不全リスクを定量できる11,12。実際、大動脈弁狭窄症において狭窄により発生するエネルギー損失が生命予後を規定するといった報告13や、Fontan循環においてエネルギー損失と主心室拡張能が相関するといった報告14もあり有力な指標であると言える。
VFMで可視化・定量される指標
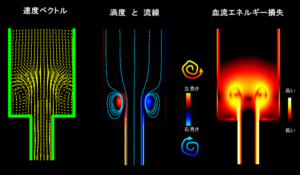
血流場をベクトルとして可視化することで渦流の大きさや向き、弁狭窄部のジェット流など大局的な流れの特徴を直感的にわかりやすく表示することができる。しかし、血流をベクトルで見る歴史はまだ始まったばかりで、我々は慣れていない。そこに形成される渦流がどのような意味を持っているのか、それが良いことなのか悪いことなのか、ベクトルを見ているだけでは結局よくわからない。そこでこうした血流がどのような意味を持っているのかを論じるために、血流ベクトル場から様々な指標を算出するということがしばしば行われる。VFMでもエネルギー損失や壁ずり応力、渦度といった流体力学的に定式化されている指標を計測することができるようになっている。
(1) エネルギー損失
血流は静圧のポテンシャルエネルギーと血流の運動エネルギーの和(全圧)として力学的なエネルギーを保持している。静圧と運動エネルギーは流れの中で等価に変換されることはベルヌーイの定理などで有名であるが、流れ場の中で乱流など流体がこすれあうことにより、血液の粘性に応じて一部が摩擦熱となって失われる。これを定量化したものがエネルギー損失である。エネルギー損失はざっくり言えば圧力損失をリアルタイムで厳密に計測したようなもので、エネルギー損失の大きさは末梢に到達する血圧のロスを意味する。したがって、末梢で循環が成立するだけの圧を保持するためには、より大きなエネルギーをもって心臓が血液を拍出しなければならず、心筋に掛かる余剰な負荷が大きくなる。小児先天性心疾患の血流可視化においてもエネルギー損失はよく用いられ、Norwood手術を始めとした再建大動脈の血流や、Fontan循環などのエネルギー効率を見ることで遠隔期の心不全リスクを定量できる11 12。実際、大動脈弁狭窄症において狭窄により発生するエネルギー損失が生命予後を規定するといった報告13や、Fontan循環においてエネルギー損失と主心室拡張能が相関するといった報告14もあり有力な指標であると言える。
VFMにおいてエネルギー損失は血流速度の空間的な分布から算出され、各点においての損失の程度を式(1)で表すことができる。(Itatani, 2014)
μは血液の粘性(VFMソフトウェア上では文献値から0.004 Pa・sと設定)で、括弧内は血流速度の空間的な勾配を表す。特に血流速度勾配は二乗される形になっており、乱流などの流れの方向がバラつくような流れや血流が壁などに衝突するような流れにおいてエネルギー損失は爆発的に大きな値をとる。この式(1)を流れ場の各点において求め、それらを空間的に積分することで、全体でどれだけエネルギーを損失したかを定量することが可能である。その際エネルギー損失はVFMではmW/m(ミリワット毎メートル)という単位で算出される。”/m”となっているのは本来3次元空間を流れている血流を2次元の超音波で計測しているために付随したものである。
ところで、エネルギー損失は一般的には式(2)のように表される。
これは流入部と流出部で全圧エネルギー(静圧+動圧)がどの程度変化したかということを表しているが、我々は(1)を空間的に積分したエネルギー損失と、式(2)のエネルギー損失が数学的に同等であることを証明している。16 VFMでは静圧がわからないという制約から式(1)でエネルギー損失を求めているが、これらの式からもエネルギー損失が圧損につながるということがお分かりいただけるであろう。
(2) 壁ずり応力
壁ずり応力は血流が心筋や血管の内膜をこすりつける力で、壁近傍での血流速度勾配から算出される。この力は内膜の変性に関わり17、小児先天性心疾患の再建大動脈においても血管の再狭窄のリスクを評価するパラメータとして重要視されている11。
(3) 渦度(vorticity)と循環(circulation)
複雑な流れ場の中には大小様々な渦流(vortex)が形成される。その中には例えば上述の正常左室における流れの方向をスムーズにターンさせるような渦流やバルサルバ洞で形成される弁を閉鎖させまた冠動脈へ血流を導くような渦流18など、生体内で合目的性をもって存在する渦もあれば、乱流と呼ばれる様々なスケールで無秩序に発生する渦流 (うねりを伴う渦でeddyと呼ばれる) など良くなさそうな渦流も存在し、渦流の様相は血流動態を特徴付ける大きな要素となっている。こうした渦流を定量的に表す指標が渦度(vorticity)である。 渦度は速度ベクトルの旋回の強さを定量する指標で、気象学においても古くから大局的に気象の状況を見通すために使われてきたようである。渦度は式(3)により定義される。
渦度には正負があり、符号は渦流が左巻か右巻きか、値は渦流の旋回の強さを表しており、VFMソフトウェア上では図のように赤を右巻きの渦、青を左巻きの渦として表現している。渦というと空間的に広がりをもってクルクルと回転する流れというイメージであるが、式からもわかるように渦度は点で求められる指標であり概念として理解が難しい。また渦度は渦を内在するずり速度が大きい流れも表すため、例えば図の壁近傍に見られるように、一見して平行な流れの様相を呈している場所でも渦度が高くなる部分があり不思議に思われるかもしれない。渦度のイメージを掴むためには、ちょうど重いものを動かす時に地面との間に挟んで摩擦を小さくするコロのようなものだと考えるとわかりやすい。赤い渦は右回りのコロ、青い渦は左回りのコロで青と赤のコロに挟まれた血流はベルトコンベアのように輸送され、適切にコロが配置されていればスムーズに血流は運搬されるが、不適切なコロの配置であれば運搬の効率は悪くなる。このようにして渦度を考えると、渦がどのように心室内で機能しているかということが見えてくるのではないだろうか。
また循環(circulation)は渦の周囲を丸で囲みその線上でベクトルを線積分することで求められる。理論的には囲まれた内部の渦度の総和に相当し、渦の大きさと強さを表す指標である。
VFMの利用上の限界
VFMは他の血流可視化モダリティに比べて極めて簡便に、精度よく血流をベクトルとして可視化できる手法であるが、万能に使えるわけではない。以下のような例はVFMの解析が適さないとされる16。
①3次元的な複雑な流れ
VFMは2次元の超音波計測断面上のものであるため、右室や大動脈など2次元の断面で十分に捉えられない解剖を有する部位では計測が困難である。またVFMの前提として2次元の断面内で流量が保存していること、すなわち計測断面の2次元の領域に外から流入してくる血流や領域の中から外へ流出する血流量が十分に小さいという条件が必要なため、例えば左室短軸像など断面を通過する流量が大きい断面では精度が低下することが考えられる。
②折り返しのある血流
カラードプラ計測は発信する超音波信号と受信する超音波信号の周波数の差から血流速度を見積もっているが、周波数の差がNykist周波数を超えると正しく計測することができなくなる。周知にようにこれを折り返し現象と呼び、VFMではこの折り返しによってベクトルの向きが実際とは異なるあらぬ方向に向いてしまい、各種指標も正しく計算できなくなる。この折り返しは折り返しがNykist limitを少しだけ超えるような軽微なものならば手動で補正できるが、数倍を超えて折り返すようなジェット流れでは補正ができず正しく可視化ができなくなる。また、折り返しが心筋壁や血管壁に接する部位に発生した場合も、折り返しのエラーを含んだ血流速度と心筋壁の速度が混ざることで補正が不可能になる問題がある。
血流の計測可視化はMRIがこれまでの主たる手段であった。血流可視化に対する注目は日に日に高まっているが、こうしたモダリティは技術的な障壁が高いために臨床現場で簡単に導入できるものでなく研究室ベースで用いられるものであった。 超音波VFMは2次元平面やNykist limitの制限があるものの従来の血流可視化モダリティに比べて極めて簡便に短時間で血流の可視化ができ、日常的な診療に血流解析を取り入れる可能性を開くものであると我々は考えている。血流可視化のエビデンスも徐々に構築されはじめており、物理学や工学の堅固な理論ベースに基づいたVFMを始めとした血流可視化技術は次世代の予測医療を担っていくものになるであろう。
参考文献